Поиск и разработка противовирусных соединений
Лаборатория проводит направленный поиск новых вирусингибирующих веществ, основанный на особенностях молекулярной биологии репродукции вирусов, скрининг in vitro химических библиотек и идентификация в их составе соединений с высоким противовирусным потенциалом.
Лаборатория сотрудничает со многими коллективами специалистов в области синтетической химии, в России и за рубежом. Получаемые вещества проходят комплексное тестирование на противовирусную активность для оценки их терапевтического потенциала.
Список вирусов, на которых ведутся исследования in vitro и in vivo, включает вирусы всех существующих групп с точки зрения организации генома и наличия оболочки, в том числе вирусы гриппа A человека и птиц, вирусы гриппа B, вирусы парагриппа, аденовирусы человека и птиц, респираторно-синцитиальный вирус, герпесвирусы (HSV-1 и -2, цитомегаловирус человека), энтеровирусы, коронавирусы, риновирусы, вирусы кори, краснухи, паротита, ротавирусы, и др.
Изучение механизма защитного действия эффективных противовирусных соединений
В сотрудничестве со специалистами в области компьютерных расчетов мы проводим моделирование взаимодействия низкомолекулярных соединений с мишенями, молекулярный докинг и выработку критериев для направленного синтеза специфических лигандов:
- Оценка эффективности разработанных соединений на компьютерных моделях, бесклеточных системах и на моделях вирусных инфекций в клеточных культурах;
- Изучение способности вирусов к выработке резистентности к новым препаратам, изучение механизмов вирусной устойчивости;
- Оценка цитотоксических свойств химических соединений в отношении клеток различных линий.
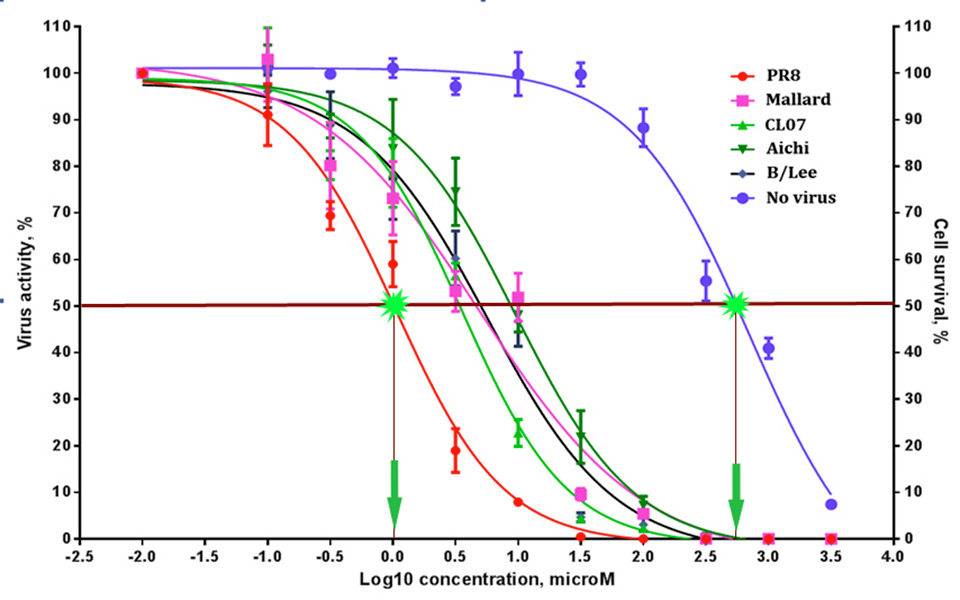
Для всесторонней оценки противовирусной активности исследуемых соединений в лаборатории используется широкий диапазон методик in vitro. Выбор конкретного методологического подхода в большой степени определяется биологическими особенностями вируса и задачами эксперимента. По результатам выполненных тестов рассчитываются такие количественные показатели активности соединений как EC50 – 50% эффективная концентрация, IC50 — 50% ингибирующая концентрация, СС50 – 50% цитотоксическая активность, SI – индекс селективности.
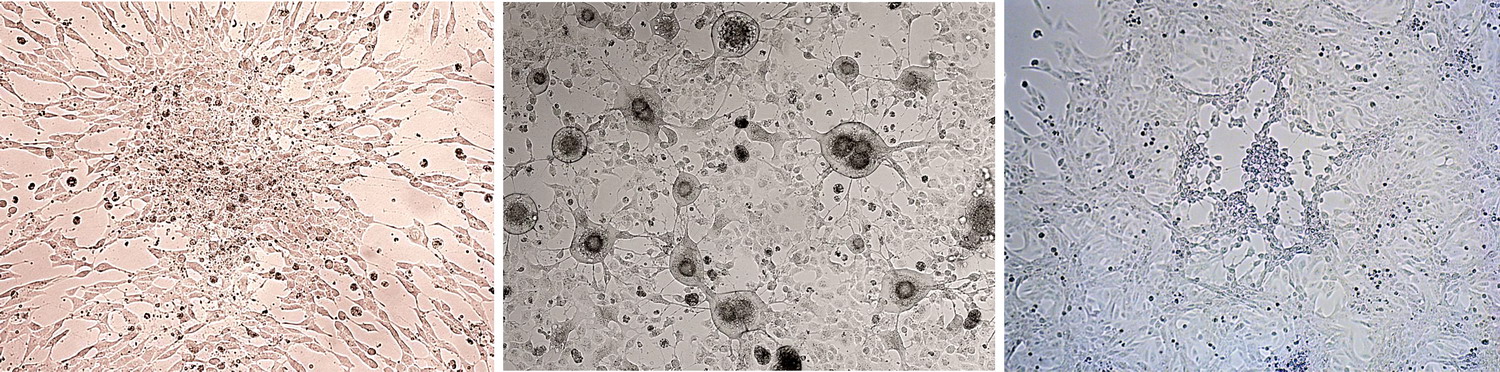
Самыми распространенными методами оценки защитных свойств исследуемых соединений являются тест на цитопротекцию (cytoprotection assay) и тест на ингибирование цитопатического действия вируса (CPE inhibition assay). Оба теста выполняются в формате 96-луночных планшетов с подготовленным монослоем пермиссивной клеточной культуры, которую инфицируют соответствующим вирусом в присутствии выбранных концентраций исследуемых соединений. Через несколько суток инкубации в каждой лунке планшета оценивают жизнеспособность клеток с помощью метилтетразолиевого теста (тест на цитопротекцию) или определяют степень выраженности цитопатического действия с использованием микроскопа или окрашивания фиксированного монослоя клеток кристаллическим фиолетовым.
Для вирусов, образующих в монослое клеток специфические негативные колонии (бляшки) возможно выполнение теста на ингибирование бляшкообразования (plaque reduction assay). Принцип данного метода состоит в следующем: подготовленный монослой пермиссивной культуры клеток в многолуночных планшетах инфицируют выбранной дозой вируса, после чего в лунки вносят покрытие, состоящее из агаризованной поддерживающей среды с добавлением серийных разведений исследуемых соединений. Спустя определенное время инкубации учитывается степень снижения вирусной активности (числа негативных колоний в каждой лунке) в зависимости от концентрации исследуемого соединения.
В отдельных случаях для получения более точной информации о способности исследуемых соединений подавлять репродукцию вируса проводят тест на ингибирование вирусной репродукции/тест на снижение продукции вирусного потомства (virus yield reduction assay). В данном случае вирус культивируется в пермиссивной клеточной культуре в присутствии серийных разведений исследуемого соединения в течение 24-48 часов, после чего количественно определяют активность репродукции вируса в виде титра вирусного потомства (титр вируса может быть выражен в ТЦД50 или геномных копиях) в зависимости от концентрации исследуемого соединения.
Для исследования противовирусной активности ингибиторов нейраминидазы вируса гриппа в лаборатории используют специфический тест MUNANA. Анализ активности нейраминидазы включает в себя добавление субстрата 2′ — (4-метилумбеллиферил)-α-D-N-ацетилнейраминовой кислоты (MUNANA) к серийно разведенному вирусу гриппа. Количество флуоресцентного конечного продукта (в единицах флуоресценции), образующегося при ферментативной реакции расщеплении MUNANA нейраминидазой вируса гриппа, измеряется с помощью флуориметра.
Также в некоторых случаях лаборатории используется метод клеточного ИФА (cell-based ELISA) для оценки противовирусной активности исследуемых соединений. При этом присутствие вируса в инфицированных клетках в присутствии серийных разведений исследуемых соединений определяется по окрашиванию монослоя клеток вирус-специфическими антителами, которые взаимодействуют с вирусными антигенами внутри клеток или на их поверхности.
При необходимости лаборатория может разрабатывать и применять другие тесты по оценке противовирусной активности образцов.